
文章解读+创新点拓展,为您带来科研新体验~
近年来,免疫检查点抑制剂(ICIs)在治疗错配修复缺陷(dMMR)和微卫星高度不稳定(MSI-H)的结直肠癌(CRC)方面取得了重大进展。最近的一项发表在Cancer Cell的研究性文章Remodeling of the immune and stromal cell compartment by PD-1 blockade in mismatch repair-deficient colorectal cancer,利用单细胞RNA测序(scRNA-seq)和多重荧光免疫组化技术(mIHC),揭示了ICI治疗前后免疫和间质细胞群的变化特征,为理解ICI治疗效果提供了重要线索。
dMMR/MSI-H的结直肠癌因其较高的肿瘤新抗原负荷和更密集的免疫细胞浸润,被认为是免疫治疗的理想靶标。ICIs针对PD-1/PD-L1途径的阻断已证明在这一患者群体中非常有效。但是,ICIs如何引起病理完全缓解(pCR)以及肿瘤微环境中免疫细胞如何被重塑的具体机制仍有待探索。为了解决这些问题,李建霞等研究者采用了一系列先进的实验技术,包括单细胞RNA测序和多重荧光免疫组化,以深入探究ICI治疗的机制。
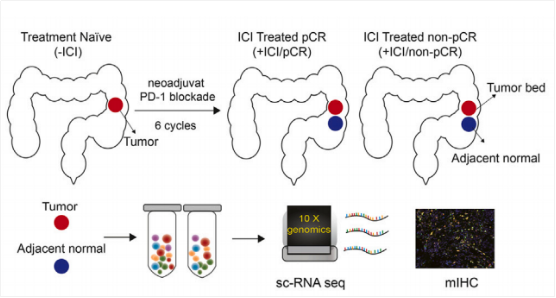
这项研究纳入了19名dMMR/MSI-H CRC患者,这些患者来自于一项前瞻性的临床2期研究,接受了新辅助性PD-1阻断剂toripalimab的治疗或者toripalimab加COX-2抑制剂celecoxib的联合治疗,其中15名患者达成病理完全缓解(pCR)。研究者共收集了40份样本进行单细胞RNA测序,其中包括27例pCR样本和15例非pCR样本。此外,还收集了74份血清样本用于细胞因子/趋化因子的量化,以及90份石蜡包埋(FFPE)样本用于多重荧光免疫组化染色。
单细胞RNA测序(scRNA-seq)技术允许研究者们在单细胞水平上量化每个细胞的基因表达模式,从而揭示细胞异质性和功能多样性。基于这项前沿技术及其后续的综合分析,研究人员对接受ICI治疗的dMMR/MSI-H结直肠癌患者的免疫和间质细胞群进行了全局分析(图1),揭示了细胞群在ICI治疗前后的动态变化,展示了整合所有样本后的聚类分析结果,这些样本被分为六个主要细胞类型集群,包括T/I/NK细胞(T细胞/先天淋巴细胞/NK细胞)、B细胞、髓系细胞、上皮细胞、内皮细胞和成纤维细胞。研究者们发现,在pCR的患者中,T/I/NK细胞、成纤维细胞和内皮细胞的频率在ICI治疗后显著增加,而在未达到pCR的患者中则没有这种趋势。
 图1:对接受ICI治疗的d-MMR/MSI-H CRC患者的免疫和基质细胞群的全局分析
图1:对接受ICI治疗的d-MMR/MSI-H CRC患者的免疫和基质细胞群的全局分析
考虑到dMMR/MSI-H肿瘤中CD8+T细胞浸润较高,且是ICI治疗响应的关键之一,研究者首先关注了ICI治疗对CD8+ T细胞的影响(图2)。整体上看,pCR患者CD8+T细胞展现出细胞毒性上调而非pCR患者则展现出耗竭和增殖的上调。其中,pCR患者在ICI治疗后CD8+ Tem细胞比例显著增加,而CD8+ Trm-mitotic细胞的比例下降,前者富集了细胞毒性特征而后者富集了耗竭特征。进一步分析发现(图3),ICI不仅增加了CD8+ Tem细胞比例,也上调了抗原呈递和细胞杀伤能力;此外,ICI还上调了CD8+ Trm细胞的杀伤能力,尽管这些细胞也表现出耗竭的特征。这些结果揭示了CD8+ T对ICI治疗响应的重要作用。
 图2:CD8 T细胞的细胞毒性和增殖程序中与ICI相关的变化
图2:CD8 T细胞的细胞毒性和增殖程序中与ICI相关的变化
 图3:ICI相关变化与CD8+ Trm转录组改变之间的共同特征
图3:ICI相关变化与CD8+ Trm转录组改变之间的共同特征
对其它免疫细胞分析后,研究者发现,ICI治疗后,pCR患者肿瘤组织中CD4+Treg减少,而多种CD4+辅助T细胞(Th)增加,特别是CD40LG+CD4+Th的增加可能抑制了CD8+T细胞的耗竭;同时,CD20+ B细胞增加,并与CD8+ T细胞的变化相关,其中生发中心B细胞(Bgc)增加最为显著(图4)。此外,研究者还发现pCR患者ICI治疗后具有促炎特征的IL1B+单核细胞显著减少,并且残留的IL1B+单核细胞炎症反应减弱(图5)。这些结果进一步揭示了ICI如何重塑肿瘤免疫微环境以增强肿瘤细胞杀伤。
 图4:CD4+ Th和CD20+ B细胞在ICI治疗后协同扩张
图4:CD4+ Th和CD20+ B细胞在ICI治疗后协同扩张
 图5:ICI治疗后髓系细胞的促炎程序减少
图5:ICI治疗后髓系细胞的促炎程序减少
内皮细胞和成纤维细胞等间质细胞也是肿瘤免疫微环境的重要参与者,前者在治疗后pCR患者的肿瘤组织中减少而后者则增加,而非pCR患者则没有这种变化(图1)。基于进一步聚类(图6)后发现肌成纤维细胞、CXCL12+成纤维细胞和HLA-DRA+内皮细胞增加而PLVAP+内皮细胞和CCL2+成纤维细胞则减少。CXCL12+成纤维细胞与免疫细胞CXCR4表达上调相关,提示成纤维细胞通过CXCL12-CXCR4轴参与免疫细胞募集。
HLA-DRA+内皮细胞则可能通过增强向CD4+T细胞的抗原呈递从而加强对肿瘤的免疫反应。而PLVAP+内皮细胞和CCL2+成纤维细胞则表达促炎和促肿瘤因子IL-32并可能参与炎性细胞募集。这些结果进一步深化了对ICI后肿瘤免疫微环境重构的认识。
 图6:ICI处理后的基质细胞重塑
图6:ICI处理后的基质细胞重塑
最后,研究者总结了pCR患者和非pCR患者ICI治疗前后微环境各类细胞的变化(图7A&B),发现促炎表型与免疫抑制微环境关系密切,比如促炎的IL1B+单核细胞与CD8+T细胞的耗竭和增殖相关(图7C)以及Treg的分子表型与炎症诱导的Treg相似等。基于本项研究,研究者全面描绘了ICI前后pCR患者和非pCR患者肿瘤微环境重塑的特征,并推测促炎细胞和分子是影响ICI治疗响应率的重要因素和潜在的干预靶点。
 图7:促炎的IL1B+ Mono细胞在非pCR组中富集
图7:促炎的IL1B+ Mono细胞在非pCR组中富集
研究者基于对单细胞测序结果的分析,描绘了ICI治疗前后pCR患者和非pCR患者肿瘤微环境的变化,这需要进一步的组织学验证,为此,研究者还采用了多色免疫荧光技术进行多重免疫组化(mIHC)技术,检测了ICI治疗前后pCR患者和非pCR患者多种肿瘤微环境细胞在肿瘤组织中的分布(图4C、5E、7D),得到了与scRNA-seq一致的结果。相比于传统组织学染色,mIHC技术使研究者得以通过多种标记在组织样本上更精细地区分细胞亚类及其分布,直观地展现了ICI治疗和疗效相关的肿瘤微环境细胞类型和功能重塑。
● 单细胞RNA测序(scRNA-seq)
单细胞RNA测序技术近年来得到了迅速发展,它能够以单细胞分辨率对细胞内的转录组进行测序,从而揭示细胞间的异质性及其生物学功能。除了在本研究中对免疫细胞和间质细胞的动态变化进行探究外,scRNA-seq在其他科研领域也有广泛的应用:
1. 发育生物学:通过对不同发育阶段的细胞进行scRNA-seq分析,科学家们可以追踪细胞分化轨迹,揭示干细胞向各种成熟细胞类型转变的过程。
2. 神经科学:该技术被用于研究大脑中不同区域细胞类型的多样性,帮助理解神经元和胶质细胞的功能特性和相互作用。
3. 癌症研究:除了本文讨论的结直肠癌免疫微环境,scRNA-seq也被广泛应用于乳腺癌、肺癌等其他类型癌症的研究,以探索肿瘤异质性、耐药机制和转移潜能。
4. 再生医学:在组织工程和再生医学领域,scRNA-seq被用来研究干细胞的分化潜力,指导组织再生过程中的细胞命运决定。
● 多重荧光免疫组化(multiplex immunohistochemistry, mIHC)
多重荧光免疫组化是一种能够同时检测组织样本中多个抗原的技术,通常与高分辨率成像系统结合使用。它的优势在于能够提供细胞的空间定位信息,这对于理解细胞间相互作用至关重要。mIHC技术的应用领域包括:
1. 免疫学:通过mIHC技术,研究人员能够详细描绘免疫细胞在感染或疾病状态下的空间分布,以及它们与其他细胞类型之间的相互作用。
2. 肿瘤微环境:mIHC被广泛应用于研究肿瘤微环境中的免疫细胞浸润,特别是T细胞、巨噬细胞和树突状细胞等,这对于理解肿瘤发生和发展过程中的免疫逃逸机制非常重要。
3. 神经系统疾病:在阿尔茨海默病、帕金森病等神经退行性疾病的研究中,mIHC可用于识别特定的神经细胞类型和炎性细胞的分布,帮助揭示疾病的发病机制。
4. 传染病:在HIV、COVID-19等病毒性感染的研究中,mIHC可以用来研究病毒在宿主细胞中的分布和免疫细胞的反应。
本研究为理解ICI治疗在dMMR/MSI-H结直肠癌中的作用机制提供了重要线索,并为进一步的临床转化奠定了基础。随着更多相关研究的展开,我们有望看到免疫治疗领域取得更大的突破,为患者带来更多的希望。
综上所述,这项研究不仅揭示了ICI治疗在dMMR/MSI-H结直肠癌中的作用机制,也展示了单细胞RNA测序和多重荧光免疫组化技术在理解免疫微环境重塑方面的巨大潜力。这些发现为未来的临床实践提供了重要的参考,并预示着免疫治疗领域将会有更多的突破。
注:本文旨在介绍医学研究进展,不做治疗方案推荐。如有需要,请咨询专业临床医生。
参考文献
Li J, Wu C, Hu H, Qin G, Wu X, Bai F, Zhang J, Cai Y, Huang Y, Wang C, Yang J, Luan Y, Jiang Z, Ling J, Wu Z, Chen Y, Xie Z, Deng Y. Remodeling of the immune and stromal cell compartment by PD-1 blockade in mismatch repair-deficient colorectal cancer. Cancer Cell. 2023 Jun 12;41(6):1152-1169.e7.