
仿制药由于戴了“仿制”这个帽子,先入为主地让人觉得是“假药”、“伪劣药”、“仿冒药”,可药品这种涉及生命健康的产品,真的能如此“儿戏”吗?今天“中国医疗保险”带您了解一下一粒集采仿制药需要经过哪些严格的层层筛选把控才能送到患者手里。
与其他领域不同,创新药开发周期较长、且成功概率低,需要经分子筛选、药学研究、1-3期临床、上市申请等过程才能获批。由于项目后期开发过程中介入人员较多,为了防止技术信息泄露,化合物专利需要在早期阶段申请。
当充分平衡早期申请(上市后保护期限较短)及晚期申请(技术泄露风险高)的利弊之后,通常化合物专利在一期临床试验启动前提出申请,说明书至少要公开一种用途和制备方法,效果数据一般至少提供细胞活性数据,视情况加入动物试验数据。同药品注册要求不同,不需提供新药在人体中的试验数据,化合物专利一旦授权,仿制药公司无法规避。
原研药在专利保护期内,药企对其有效成分、制药工艺、剂量形式等拥有独家权利,这些信息通常不会公开。在专利保护阶段,被专利保护的药品不可进行仿制,否则即使疗效相同,也在法律上认定其为“假药”。
有一个以仿制药著称全球的国家例外——印度,印度有专利强制许可,印度在1970年颁布的《专利法》中明确表示:印度的企业可以合法仿制其他国家医药企业的专利药品。我们以2018年上映的电影《我不是药神》举例,影片中有三种“药”,一种是瑞士在专利保护期内的原研药格列宁;另一种是男主程勇代购的印度仿制药“格列宁”;还有就是假药贩子张长林卖的“扑热息痛加面粉”的假药。其中印度仿制药在当时被称为“假药”的原因是由于其未经批准进口,但是2019年《药品管理法》修订,没有再把未经批准进口的药品列为假药,而是把未经批准进口的药品从假药里面拿出来单独规定。

图片来源:电影《我不是药神》,如有侵权,请联系删除
原研药专利到期过后,仿制药企业可以生产相同的药物,质量标准一致、并且生物等效,国家审批通过后,可上市销售。
仿制药被误解“仿冒药”的原因多是由于“仿制”二字,其来源于英文“generic drug”,其中“generic”一词在药品领域指的是那些专利保护期过后,其他制药公司可以合法生产的药品,这些药品的化学成分、药效和适应症与原研药相同,但通常价格更低。
之所以称为“仿制药”,是因为这些药品在研发时不需要进行原研药所经历的完整临床试验过程,而是通过证明其与原研药在生物等效性上是一致的,即可获得批准上市。“仿”在这里指的是它们模仿的是原研药的活性成分和治疗作用,但它们是经过严格监管和测试的,确保了安全性和有效性。
仿制药的出现对于降低药品成本、提高药品可及性具有重要意义,它们帮助许多患者能够负担得起必需的药物治疗。因此,虽然名字中有"仿"字,但仿制药是合法且质量可靠的药品。
对于已经批准上市的仿制药,为保障在质量和疗效上与原研药品能够一致、临床上可以相互替代,国家药品监督管理局和国务院办公厅发布公告及相关意见要求开展一致性评价工作。通过一致性评价的药品品种,在医保支付方面将得到适当支持。
表1 原研药和仿制药审批申请的异同
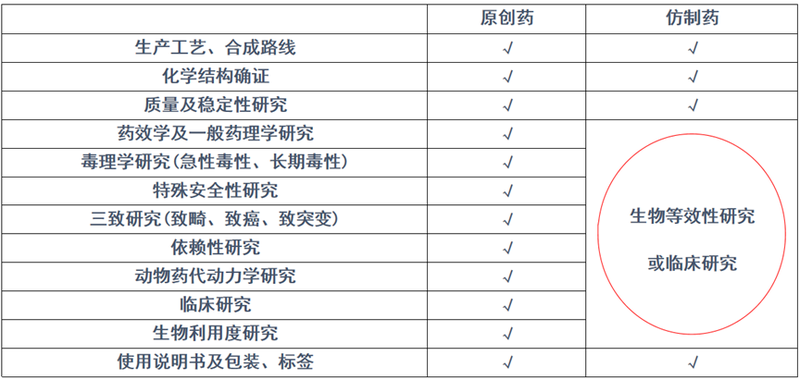
图片来源:国家组织药品集中采购中选仿制药疗效与安全性真实世界研究课题组
为避免一致性评价成为“一次性评价”,药品监管部门对通过一致性评价的品种加强监管,已经通过一致性评价的药品将纳入下一年度国家药品抽检计划,对相关企业加大监督检查力度。
经过一致性评价的仿制药的上市,可以提供更加充足的临床供应,较大幅度地降低药价,缓解患者的经济负担,具有降低医疗支出、提高药品可及性、提升医疗服务水平等重要经济和社会效益。国外统计数据显示,随着仿制药上市数量的增加,药品价格最低将下降到原研药最初价格的9%左右。
为保证患者用上高质量的仿制药,国家医保局把通过一致性评价作为集采仿制药入围的门槛。
但是,通过一致性评价并不意味着一劳永逸。监管部门也在持续进行生产、流通和使用全链条质量监管;对国家组织药品集采中选企业开展全覆盖检查、对中选药品实施全覆盖抽检,同时持续做好药品不良反应监测;督促企业持续合规,压实企业药品质量安全主体责任。对于检查、检验发现问题的,药品监管部门均依法采取严厉的处罚,并会同医保部门实施联合惩戒。
如第九批国家组织药品集中采购中选药品Dr. Reddy's Laboratories Ltd.的盐酸托莫西汀胶囊,8月30日,国家医保局网站公布公告,取消该药品中选资格并将该企业列入违规名单。经国家药监局检查,Dr. Reddy's Laboratories Ltd.的盐酸托莫西汀胶囊在原料药管理方面存在严重缺陷,未采取有效措施确保所使用原料药的有效期符合我国注册要求,另外在工艺验证、质量控制等方面存在缺陷,不符合我国《药品生产质量管理规范(2010年修订)》要求。

国家医保局网站公布公告取消药品中选资格并将该企业列入违规名单。(图片来源:国家医保局)
除全链条质量监控,国家医保局也重视集采仿制药上市后基于真实世界再评价。真实世界研究(Real World Study, RWS)与其他证据的本质区别在于获取数据的环境。真实世界研究的数据来自真实的临床环境,反映的是实际诊疗过程中和实际环境条件下患者健康状况变化,能更加客观地评价药品临床有效性和安全性,补充临床最常使用的随机对照试验的结果,特别是在药物上市后的监测、评估新干预措施在特殊人群中的效果、以及成本效益分析等方面。
国家医保局于2019年设立第一期集采中选药品疗效与安全性评价的真实世界研究课题,评价了14个慢性病和重大专科疾病治疗药物,结果显示,集采中选仿制药疗效和安全性与原研药无统计学差异,为临床合理用药提供了循证依据。
随着国家组织药品集采常态化制度化推进,更多药品纳入了集采范围,为进一步研究新批次集采中选药品疗效和安全性,2021年8月国家医保局委托宣武医院牵头启动了针对第二、三批集采中选药品的临床疗效和安全性真实世界评价研究。参与此次研究的医疗机构扩大到全国16省市29家医疗中心14万份真实病例数据,药物涉及抗感染、抗肿瘤、代谢及内分泌、心脑血管、神经精神、消化系统等6大治疗领域的23个品种,研究结果表明中选仿制药与原研药在临床有效性和安全性上无统计学差异。详见文章《第二、三批国家组织集中采购中选仿制药品疗效与安全性评价真实世界研究报告(精简版)》。第三期集采药品真实世界研究针对第四、五批国家组织集采药品,结果有待公布。今后会持续开展真实世界研究,以临床研究结果为临床医生和患者提供更多循证证据,为政策制定提供支持。
国家医保局开展集采药品的真实世界研究的主要目的是为了真实、全面地了解集采中选仿制药的安全性和有效性,确保这些药品在实际临床应用中的表现与原研药相当,保障患者使用到质优价宜的药品。

笔者关注到有人质疑集采药品真实世界研究证据等级不够高,笔者想说的是原研药甚至没有拿出权威的学术论证表明其疗效和安全,原研药质量高于仿制药的说法可能是一种感性认知。原研药质量一定高于仿制药吗?并非如此。日本存在一种奇怪现象——有的集采中标药价格甚至高于原研药,其原因在于专利过期多年且工艺成熟的仿制药质量完全有可能胜过原研药。
近年来,我国仿制药工业在质量、生产能力及市场地位等方面进步很大。一致性评价政策在审批环节严守仿制药“质量关”,我国仿制药出海数量不断增加,国际认可度的提升也从侧面说明我国仿制药水平的提高。
一粒集采仿制药要经过严格设定的重重“关卡”,成为“质优价廉”的药品才能送到患者手里,所以请广大医患群体放心,集采中选仿制药不是劣药,而是更多患者用得起的好药。国家好不容易谋来的福利,有什么理由拒之门外呢?
来源 | 中国医疗保险 舒笙
编辑 | 崔秀娟 买晓飞
热点文章

