脑转移是肺癌患者面临的严峻挑战,一旦发生脑转移,患者的预后往往急转直下,治疗难度也显著增加。一项发表在国际肺癌研究协会官方期刊Journal of Thoracic Oncology的研究性文章“Genetic Intratumor Heterogeneity Remodels the Immune Microenvironment and Induces Immune Evasion in Brain Metastasis of Lung Cancer”,通过全外显子测序(WES)评估了配对的肺癌原发肿瘤和脑转移肿瘤样本的肿瘤内遗传异质性,并与基于转录组测序(RNA-seq)技术的肿瘤免疫微环境数据结合,分析肿瘤内突变异质性与肿瘤免疫浸润和脑转移的关系,并进一步利用多重免疫荧光(mIHC)技术进行了验证。基于这项研究,作者团队提出了肺癌脑转移瘤的免疫逃逸机制模型,即肿瘤内异质性驱动了免疫重塑,从而在局部免疫压力下通过不同的机制实现了免疫逃逸。这些发现为脑转移患者制定精准免疫治疗策略提供了新的思路。
肺癌是最常见的恶性肿瘤,其中非小细胞肺癌患者中约20%-40%会发生脑转移,严重影响预后和生活质量。脑转移的发生机制复杂,涉及基因改变、肿瘤细胞侵袭性、免疫微环境及免疫逃逸等。肿瘤内部基因组改变的异质性(Intratumor Heterogeneity,ITH)影响肿瘤生长与发展,并可能改变免疫微环境,促进免疫逃逸。大脑的独特免疫特性及其血脑屏障保护为肿瘤细胞提供了特殊的生存条件,进一步影响了免疫系统的抗肿瘤作用。然而,脑转移过程中时间和基因组改变之间的相互作用尚不清楚,需要更广泛的机制研究,理解这些机制对于开发有效治疗策略至关重要。
在这一背景下,本研究旨在通过综合分析肺癌脑转移样本,探讨遗传异质性如何影响肿瘤免疫微环境,并揭示脑转移过程中肿瘤细胞是如何逃避免疫系统监视的进化模型。研究结果将有助于更好地理解脑转移的生物学机制,为开发新的免疫治疗策略提供理论依据。
研究设计与结果

图1:研究思路
本研究收集了22例手术切除的原发肺癌组织(LPs)、匹配的正常组织以及脑转移瘤(BMs)标本,提取DNA和RNA并进行质量控制后,进行全外显子测序(WES)和转录组测序(RNA-seq),根据实验结果进行数据分析和解读。进一步利用多重免疫荧光(mIHC)技术验证数据分析结果。提出肺癌细胞在脑转移过程中的克隆进化模型。
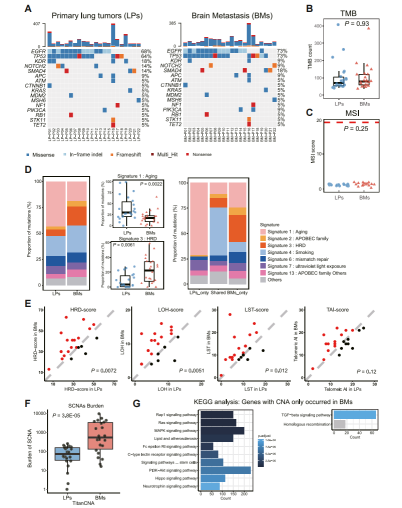
图2:配对原发肿瘤和脑转移的基因组景观
该团队首先通过分析WES数据,寻找功能驱动基因(致癌、治疗、预后相关的基因)突变,发现脑转移肿瘤的功能驱动基因突变与原位肿瘤并无显著差异,提示驱动转移的基因突变在原位癌形成时已出现(图2A)。原发肿瘤和脑部转移瘤的肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)状态亦没有显著差异(图2B、C)。
进一步的分析发现脑部转移瘤中存在更多的同源重组缺陷(HRD)和体细胞拷贝数改变(SCNA)(图2D、E、F)。KEGG通路富集分析发现具有拷贝数改变(CNA)的信号通路(图2G)。这些结果提示脑转移是通过基因组不稳定性的持续积累而非新型驱动SNV的引入引起的。
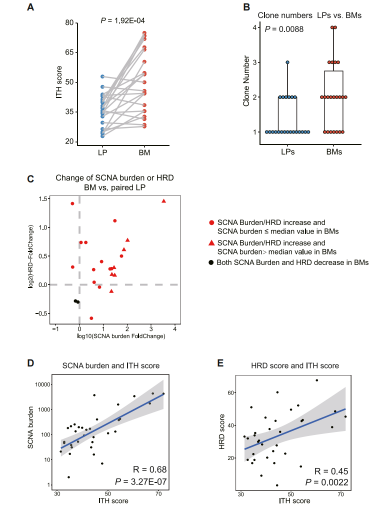
图3:配对原发性肺肿瘤和脑转移瘤的肿瘤内遗传异质性
计算肺部原发肿瘤和脑部转移瘤的遗传异质性分数(ITH score),发现脑部转移瘤的更高(图3A)。且ITH score与HRD score、SCNA burden呈正相关(图3D、E)。说明肿瘤内遗传异质性增加在转移过程中的关键作用,这主要由HRD或SCNA引起,导致基因组不稳定性和基因组复杂性增加。
 图4:配对原发性肺肿瘤和脑转移的免疫微环境的异质性
图4:配对原发性肺肿瘤和脑转移的免疫微环境的异质性
为了表征肿瘤免疫微环境,研究者通过分析RNA-seq数据原发性肺肿瘤和脑转移的免疫细胞浸润水平,并进行了聚类(图4A、C)分析,发现脑转移肿瘤中免疫细胞浸润减少,包括CD4+和CD8+T细胞,而PD-L1+细胞的密度则没有变化,表明脑转移瘤处于不活跃的免疫微环境。对肿瘤组织的多重免疫荧光染色验证并可视化了这一结果(图4E)。进一步分析发现免疫细胞浸润与ITH评分负相关(图4F、G),提示肿瘤内遗传异质性的增加对于脑转移的发展有着重要作用。
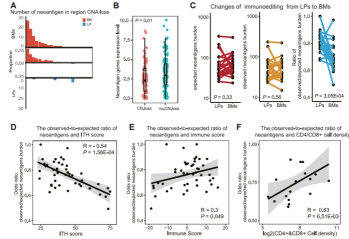
图5:伴有脑转移的肺腺癌(LUAD)患者的新抗原缺失和免疫编辑
那么肿瘤内遗传异质性的变化为什么会导致免疫微环境的变化呢?研究发现脑转移瘤可能有更多DNA和RNA水平的新抗原去除(图5A、B、C),提示“免疫编辑”事件(肿瘤演化过程中,肿瘤细胞受到免疫系统的识别、清除,从而筛选出对免疫系统高抗性的肿瘤克隆)增加,这些新抗原去除的肿瘤细胞对免疫系统的激活能力更弱。这种新抗原去除事件与ITH评分负相关,而与免疫评分正相关,提示,新抗原去除或介导了肿瘤内遗传异质性增加引起的免疫浸润降低。通过mIHC进一步验证肿瘤的免疫编辑状态,也发现CD4+和CD8+T细胞密度与新抗原去除呈正相关(图5F)。
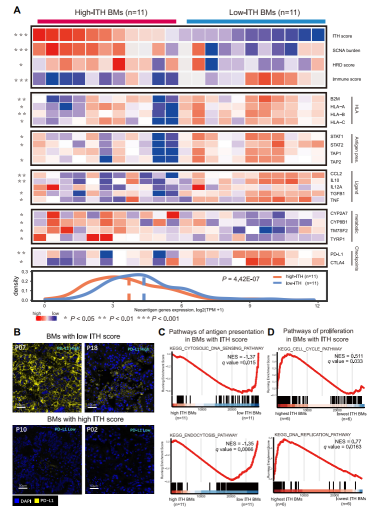
图6:LUAD合并脑转移患者的ITH和免疫逃逸
通过ITH评分将脑转移样本的数据分为2组[高ITH组(上50%)与低ITH组(下50%)],发现MHC I类抗原呈递分子基因、新抗原呈递相关基因、免疫共刺激分子基因表达在高ITH组中降低(图6A)。GSEA分析发现在高ITH组高的脑中,两个抗原呈递途径,胞质DNA感应途径和内吞途径显著低活动(图6C);相反,细胞周期和DNA复制途径的活性显著升高(图6D)。有趣的是在低ITH组中,免疫抑制性免疫检查点分子CTLA-4和PD-L1表达均上调(图6A),通过mIHC验证了这一结果(图6B)。基于这些结果,研究人员认为,高ITH(高肿瘤内遗传异质性)和低ITH的脑转移肿瘤存在两种不同的免疫逃逸机制:高ITH肿瘤通过干扰抗原呈递,而低ITH肿瘤则通过上调免疫检查点分子。
 图7:LUAD脑转移中免疫逃逸机制的模型
图7:LUAD脑转移中免疫逃逸机制的模型
综上所述,本研究提出一个全面的免疫入侵机制模型:高ITH和低ITH脑转移中不同的免疫逃逸机制。在脑转移的进化过程中,新抗原的积累可能会诱导局部免疫浸润,导致肿瘤细胞的死亡。高ITH的脑转移可能导致抗原呈递机制中断,包括新抗原缺失、抗原呈递缺陷和新抗原表达下调,导致免疫细胞浸润减少,包括CD8+T细胞和DC细胞减少。另外,在进化过程中,低ITH水平的亚克隆可能诱导PD-1/PD-L1轴的上调,这可能是免疫逃逸的另一种机制。其他亚克隆可能通过其他机制逃避杀戮。
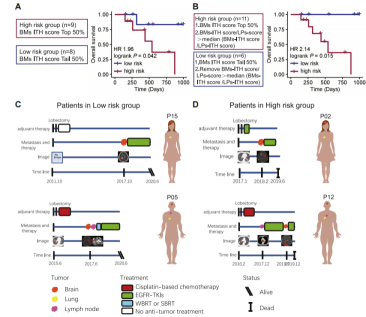
图8:肿瘤内异质性对伴有脑转移的LUAD患者预后的影响
最后,研究人员基于脑转移瘤ITH评分高低对患者分组,发现ITH高的患者预后更差(图8A),结合肺部原发肿瘤的ITH评分将患者分为高风险组和低风险组则显示出更好的总生存率预后价值(图8B)。
本研究中,使用了全外显子测序(WES)和转录组测序(RNA-seq)两种高通量测序技术,以及多重免疫荧光(mIHC)技术,全面地获取肺癌脑转移患者的遗传变异信息和转录组表达谱,为深入理解肿瘤异质性和免疫逃逸机制提供了重要的数据支持。分析一下这些技术的独特优势:
全外显子测序(WES)
● 能够检测到编码区内的单核苷酸变异(SNVs)、小片段插入缺失(indels)等遗传变异,这对于研究肿瘤内部的遗传异质性非常重要。
● 通过检测不同样本间的变异情况,可以分析肿瘤内克隆结构,识别主要克隆和亚克隆,并追踪它们的发展过程。
● WES数据帮助研究人员理解肿瘤细胞如何在脑转移过程中进行克隆演化,并揭示哪些遗传变异在这一过程中起到了关键作用。
● 通过比较原发肿瘤与脑转移瘤之间的差异,可以帮助识别可能导致脑转移的驱动变异。
转录组测序(RNA-seq)
● 能够全面地评估样本中的转录本表达水平,包括mRNA和其他非编码RNA。
● 通过使用特定算法如ssGSEA(单样本基因集富集分析),可以推断样本中不同免疫细胞类型的相对丰度。
● 能够揭示脑转移瘤与原发肿瘤之间免疫微环境的差异,比如免疫细胞的类型和数量。
● 通过检测特定免疫相关基因的表达变化,可以探究肿瘤如何通过改变自身表达来逃避免疫系统。
多重免疫荧光(mIHC)
● 可以同时检测多个免疫标记物,从而鉴定和表征不同类型的免疫细胞。
● 能够显示免疫细胞在组织中的精确位置和分布模式,这对于理解免疫细胞与肿瘤细胞的相互作用非常有用。
● 可以帮助验证RNA-seq数据中推断出的免疫细胞组成,并提供细胞的空间定位信息。
● 通过观察免疫细胞与肿瘤细胞的空间关系,可以深入了解局部免疫反应的动态变化。
临床价值与展望
这项研究为肺癌脑转移的治疗提供了新的视角。首先,它强调了遗传异质性在脑转移中的重要性,提示我们在设计治疗方案时需要考虑肿瘤的多样性。其次,揭示了免疫微环境的变化,有助于开发新的免疫治疗方法,比如靶向那些促进免疫逃逸的分子或通路。此外,研究还可能指导个体化治疗策略的选择,即根据每个患者的遗传特征来定制治疗方案,以提高疗效。
总的来说,这项研究为我们理解肺癌脑转移的复杂性提供了重要见解,也为未来精准医疗的发展指明了方向。随着更多类似研究的开展和技术的进步,我们有理由相信,在不久的将来,肺癌脑转移患者的治疗前景将会变得更加光明。
注:本文旨在介绍医学研究进展,不做治疗方案推荐。如有需要,请咨询专业临床医生。
参考文献
Wang X, Bai H, Zhang J, Wang Z, Duan J, Cai H, Cao Z, Lin Q, Ding X, Sun Y, Zhang W, Xu X, Chen H, Zhang D, Feng X, Wan J, Zhang J, He J, Wang J. Genetic Intratumor Heterogeneity Remodels the Immune Microenvironment and Induces Immune Evasion in Brain Metastasis of Lung Cancer. J Thorac Oncol. 2024 Feb;19(2):252-272.
来源:梅斯医学